Felicitamos y agradecemos profundamente a nuestros distinguidos AUTORES por su generosidad al compartir sus conocimientos mediante nuestra enciclopedia virtual, obra fundada en MAYO de 2011.
También reconocemos la colaboración de nuestros lectores cuyas visitas nos motivan a continuar con este trabajo.
Nos empeñamos en ofrecer un servicio a la Cultura de la Vida. La Bioética, nueva ciencia de la vida humana, es una disciplina que convoca los estudios de las más variadas ramas del saber: la biología, la medicina, la psicología, el derecho, la filosofía, la teología, etc. Intentamos innovar nuestra enciclopedia como recurso actualizado, formando parte de la comunidad del conocimiento. La sociedad global del siglo XXI nos interpela y nos compromete a reflexionar sobre cada temática.
Ojalá encuentres en estas "voces" respuesta a tus inquietudes. Somos conscientes de que nuestro tiempo necesita volver a la "pasión por la verdad". Sólo ella nos hace libres. Nos da alas para volar al don inmenso del amor, que se vuelve responsabilidad por el otro, el más débil e indefenso.
La Universidad quiere hoy ser más todavía, testimonio de luz, ámbito comunitario de búsqueda y contemplación de la verdad. La compartimos con ustedes.
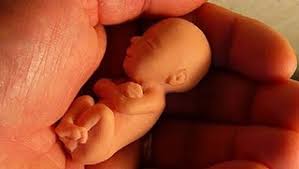
Acompañamiento Pastoral Post Aborto
Inteligencia Artificial: “Antiguo y Nuevo”
La Ética y la Inteligencia Artificial en el Cuidado de la Casa Común
Autor: Mons. Jorge Eduardo Lozano
La inmortalidad ¿algo humano o transhumano?
Análisis de los proyectos de legalización de la eutanasia y el suicidio asistido en Argentina
Autor: Jorge Nicolás Lafferriere
La muerte hoy: aportes de Emmanuel Lévinas
Adicciones: una mirada desde la Bioética
Enfermedad Cardiovascular periférica y Bioética
Autores: GARCÍA, José Juan, GODOY, Martín., NIEVAS ROMANO, María, NIEVAS ROMANO, Virginia.
Bioética y Otoño. El Adulto Mayor
Autores: José Juan García, María del Carmen Nievas Romano, Virginia Sofía Nievas Romano.
Autores: Nievas Romano, M., García, J., Godoy, M., Nievas Romano, V.
Autores: García, J.J, Nievas Romano, M. del C, Godoy, M.S. Nievas Romano, V.S.
Número de Visitas
Módulos disponibles
Salta categorías






